高中化学:原子结构示与性质解题方法与技巧归纳整理
1、能层、能级与原子轨道
(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N、O、P、Q……表示相应的第一、二、三、四、五、六、七……能层,能量依次升高
(2)能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:表示电子在原子核外的一个空间运动状态。电子云轮廓图给出了电子在核外经常出现的区域,这种电子云轮廓图也就是原子轨道的形象化描述。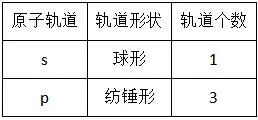
2、基态原子的核外电子排布的三原理
(1)能量最低原理:原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
(2)泡利原理:在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋方向相反。
(3)洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据1个轨道,并且自旋方向相同。洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。
3、构造原理:绝大多数元素的原子核外电子的排布将遵循如下图所示的排布顺序,人们把它称为构造原理。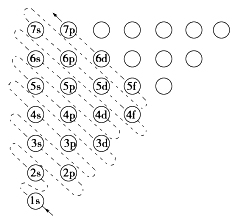
4、电离能和电负性
(1)电离能
含义:第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号I,单位kJ/mol。
变化规律:
①同周期:第一种元素的第一电离能最小,最后一种元素的第一电离能最大,总体呈现从左至右逐渐增大的变化趋势。
②同族元素:从上至下第一电离能逐渐减小。
③同种原子:逐级电离能越来越大(即I1≤I2≤I3…)。
(2)电负性
含义:不同元素的原子在化合物中吸引键合电子能力的标度。元素的电负性越大,表示其原子在化合物中吸引键合电子能力的能力越强。
标准:以最活泼的非金属氟的电负性为4.0和锂的电负性为1.0作为相对标准,计算得出其他元素的电负性(稀有气体未计)。
变化规律:
①金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
②在元素周期表中,同周期从左至右,元素的电负性逐渐增大,同主族从上至下,元素的电负性逐渐减小。
方法技巧:
1、原子的核外电子排布式(图)的书写
(1)核外电子排布式:用数字在能级符号右上角表明该能级上排布的电子数。例如,K:1s22s22p63s23p64s1。为了简化,通常把内层已达稀有气体电子结构的部分称为“原子实”,用该稀有气体的元素符号加方括号来表示。例如,K:[Ar]4s1。
(2)核外电子排布图:用□表示原子轨道,↑和↓分别表示两种不同自旋方向的电子。如氧原子的核外电子排布图可表示为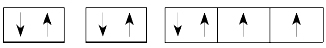
核外电子排布图能直观地反映出原子的核外电子的自旋情况以及成对电子对数和未成对的单电子数。
(3)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
(4)构造原理是书写基态原子的电子排布式的依据,也是绘制基态原子的电子排布图的主要依据之一。
2、基态原子的核外电子排布的表示方法(以硫原子为例)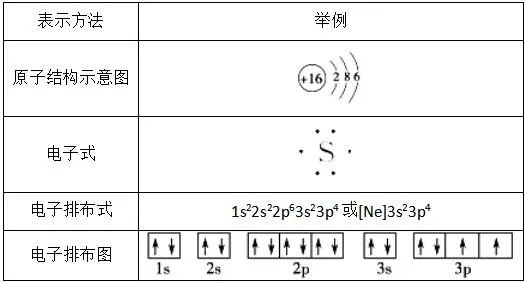
3、电离能的应用:
①判断金属性与非金属性强弱;
②分析原子核外电子层结构,如某元素的In+1≫In,则该元素的最外层电子数为n;③判断化学键类型。
4、电负性的应用:
①判断一种元素是金属元素还是非金属元素,以及金属性与非金属性的强弱;
②判断元素在化合物中的价态;
③判断化学键类型。
推荐课程
-

洛阳学大高中小班课 教学点:1个 人气:487
-

洛阳学大高二语文一对一辅导班 教学点:1个 人气:373
-

洛阳学大高一语文一对一辅导班 教学点:1个 人气:354
-

洛阳学大高二数学一对一辅导班 教学点:1个 人气:259
-

洛阳学大艺考生文化课封闭式辅导班 教学点:1个 人气:196
-

洛阳学大艺考生文化课一对一辅导班 教学点:1个 人气:181